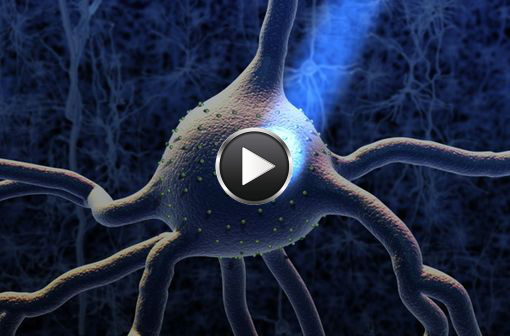
L'optogénétique permet de stimuler un neurone (ou un petit groupe de neurones) avec de la lumière bleue (illustration, © Sputnik Animation, McGovern Institute, Ed Boyden).
L'optogénétique, une technique très récente de contrôle cellulaire par la lumière
En 2002, des chercheurs allemands et italiens ont découvert, dans une algue verte unicellulaire (Chlamydomonas reinhardtii), une famille de protéines sensibles à la lumière, les channelrhodopsines (ChR). Ces protéines sont des canaux ioniques situés dans la membrane cellulaire. Leur ouverture est actionnée par un stimulus lumineux.
L'une de ces protéines, la channelrhodopsine 2 (ChR2), est activée par la lumière bleue, ce qui provoque l'entrée d'ions sodium (Na+) dans la cellule.
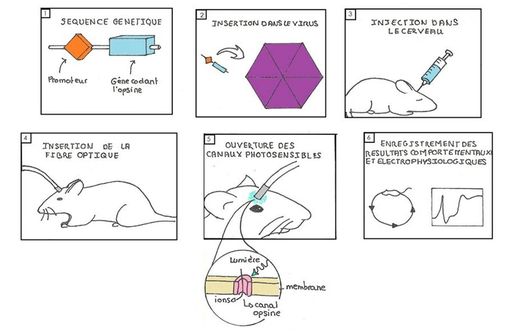
En 2005, Karl Deisseroth et ses collègues parviennent à insérer le gène codant pour la ChR2 dans le génome de neurones de mouche, en utilisant un lentivirus comme vecteur (rétrovirus désactivé). Les neurones "infectés" par ce virus vont pouvoir exprimer la channelrhodopsine 2 à leur surface, et donc devenir photosensibles : l'exposition des neurones modifiés à la lumière bleue provoque une entrée d'ions sodium, ce qui modifie leur polarité et donc leur fonctionnement (cf. schéma ci-dessous, © Wikipedia). Depuis 2005, plusieurs expériences de modification de l'activité des neurones par la lumière ont été menées sur des cellules, des vers de terre, des souris, ou encore des rats.
Avant d'envisager d'éventuelles applications cliniques (pacemakers à la lumière…), cette technologie permet d'ores et déjà de mieux comprendre certains phénomènes physiopathologiques, puisqu'elle permet de cibler de petits groupes de cellules et donc d'isoler leur comportement.
Karl Deisseroth est par exemple parvenu, en 2012, à corriger les symptômes de la dépression en activant une zone de neurones dopaminergiques dans le cerveau de souris. Cette expérience a confirmé l'hypothèse préalable que cette zone était liée à la motivation et à la récompense (Deisseroth K et coll., Nature, 2012).
Le contrôle cellulaire par la lumière : illustration vidéo
Ci-dessous (source : Abilez OJ, EMBC, 2012), vous pouvez constater l'effet contractile de la lumière bleue et l'effet inhibiteur de la lumière jaune sur une cellule souche cardiaque contenant le gène de ChR2 (entrée de cations Na+ provoquant la contraction) et celui de l'halorhodopsine (NpHR1.0 : entrée d'anions Cl- inhibant la contraction) :
Dans cette deuxième vidéo, ChR2 a été intégré au génome des motoneurones cholinergiques d'un tout petit ver de terre, le Caenorhabditis elegans : la lumière bleue active les neurones qui font se contracter les muscles (ver figé), tandis que la lumière jaune met fin à cette contraction (source : Christian Schultheis et coll., PLOS One, avril 2011) :
Un implant transparent contenant des cellules photosensibles permet d'améliorer, chez la souris, la tolérance au glucose
Les expériences actuellement menées sur des souris ou des singes nécessitent la mise en place chirurgicale d'une diode lumineuse directement en contact avec la zone-cible de l'organisme de l'animal. Lorsque la zone-cible n'est pas superficielle, la mettre en contact avec une fibre optique constitue une opération compliquée et à risques secondaires d'infection, de rejet, etc.
Afin de pallier cette difficulté, Seok Hyun Yun et ses collègues ont utilisé un implant d'hydrogel transparent à base de polyéthylène glycol contenant des cellules photosensibles : l'exposition de ces cellules à la lumière bleue entraîne une sécrétion d'une hormone, le GLP-1 (glucagon-like peptide-1). Une fibre optique relie l'implant à une source de lumière externe ou à un détecteur de lumière.
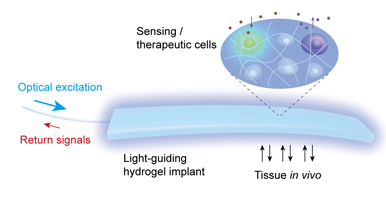
Les auteurs ont donc placé cet implant 4 cm en dessous de la peau de souris diabétiques (ce qui est profond pour une souris…), les ont exposées pendant 12 heures à la lumière bleue et ont ensuite constaté qu'elles avaient une meilleure tolérance au glucose que les souris diabétiques témoins (le taux sanguin de GLP-1 avait doublé).
Il reste encore à trouver le moyen de se passer de fibre optique (par exemple avec des micro-leds activables à distance, sans fil), mais ce travail multi-disciplinaire est déjà prometteur : "ce travail combine plusieurs technologies existantes bien connues dans leurs domaines respectifs - telles que l'administration de médicaments, le génie génétique, la science des biomatériaux et la photonique - pour construire un nouveau système d'implant qui permet de délivrer une photothérapie profondément dans le corps", résume Seok Hyun Yun.
En conclusion
Depuis une dizaine d'années, les travaux scientifiques autour de l'optogénétique se multiplient : plus de 400 études ont déjà été publiées, des dizaines d'autres sont en cours.
Cette technologie permet d'envisager une meilleure compréhension des pathologies liées au dysfonctionnement d'une population réduite de cellules. Elle pourrait également, d'ici quelques années, permettre de corriger certains dysfonctionnements, en particulier électriques, de ces cellules. A suivre !
Jean-Philippe Rivière
Sources et ressources complémentaires :
- "La révolution optogénétique dans la biologie moderne", Philippe Isope et Matilde Cordero-Erausquin, Lettre des neurosciences, Société des neurosciences, printemps-été 2011
- "New Technique Opens Window Into Brain Research", Valerie Thompson, Ph.D., AAAS Science and Technology Policy Fellow, National Science Foundation, mai 2013 (article dont provient l'illustration de cet article © Sputnik Animation, McGovern Institute, Ed Boyden)
- "Optogénétique", Wikipedia (source du dessin résumant les modalités de l'utilisation de l'optogénétique sur une souris)
- "Channelrhodopsin-1: a light-gated proton channel in green algae", Nagel G et coll., Science, 2002
- "Millisecond-timescale, genetically targeted optical control of neural activity", Deisseroth K et coll., Nature, 2005
- "Dopamine neurons modulate neural encoding and expression of depression-related behavior", Deisseroth K et coll., Nature, décembre 2012
- "Cardiac optogenetics", Abilez OJ, Engineering in Medicine and Biology Society (EMBC), 2012 Annual International Conference of the IEEE
- "Optogenetic Long-Term Manipulation of Behavior and Animal Development", Schultheis C et coll., PLOS One, avril 2011
- "Light-guiding hydrogels for cell-based sensing and optogenetic synthesis in vivo", Seok Hyun Yun et coll., Nature Photonics, octobre 2013
- "Hydrogel implant enables light-based communication with cells inside the body", Mass General news, 22 octobre 2013
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.