
STRESAM est désormais indiqué dans les manifestations psychosomatiques de l'anxiété.
Réévalué par l'ANSM (Agence nationale de sécurité du médicament et des produits de santé), le rapport bénéfice/risque de STRESAM 50 mg gélule (étifoxine) reste favorable mais avec les modifications suivantes du libellé d'AMM (autorisation de mise sur le marché) :
- modification de l'indication : STRESAM est désormais indiqué dans les manifestations psychosomatiques de l'anxiété. La précédente indication de STRESAM, "manifestations psychosomatiques de l'anxiété telles que dystonie neurovégétative, notamment à expression cardiovasculaire" ne correspondait plus aux critères du DSM-IV (Diagnostic and Statistical Manual of Mental Disorders) ;
- actualisation des données de pharmocodynamie : de nouvelles données de pharmocodynamie ont montré que l'activité anxiolytique de STRESAM s'exerçait principalement par un double mécanisme d'action sur le récepteur GABAA, visant à renforcer la transmission gabaergique : "une action directe et une action indirecte par l'augmentation de la production de neurostéroïdes modulateurs allostériques positifs du récepteur GABAA" selon la lettre aux professionnels de santé du laboratoire Biocodex ;
- mise à jour de la rubrique "Effets indésirables" pour intégrer ceux dont l'incidence est très faibles mais qui peuvent être graves, notamment, le risque de réactions cutanées ou allergiques, et le risque de troubles hépatiques graves. La présentation de cette rubrique a été révisée afin de classer les effets indésirables en fonction de leur fréquence (voir tableau ci-dessous extrait de la lettre aux professionnels de santé du laboratoire Biocodex) :
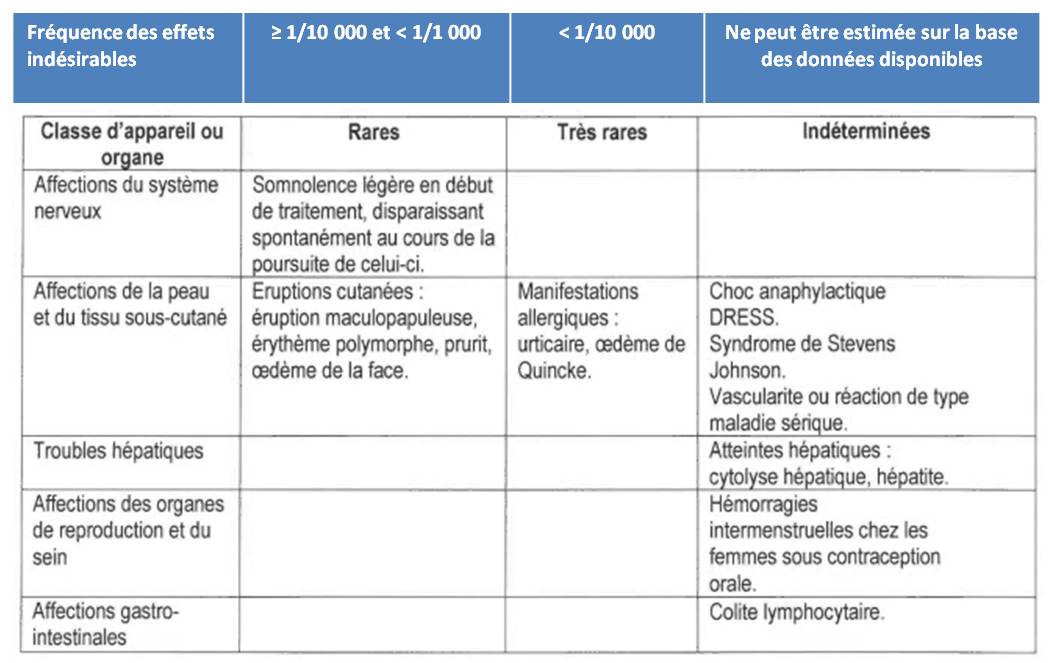
- mise à jour de la rubrique "Mises en garde spéciales et précautions d'emploi" : la mention "En cas de réactions cutanées ou allergiques, ou de troubles hépatiques graves, le traitement par étifoxine devra être immédiatement interrompu" a été ajoutée.
Informer les patients
Les patients doivent être informés par les professionnels de santé de la survenue possible de réactions cutanées ou allergiques ou de troubles hépatiques graves.
En cas de survenue d'un de ces symptômes, ils doivent consulter immédiatement un médecin.
Pour aller plus loin
Stresam (étifoxine) : Modification de l'AMM : libellé d'indication, données de pharmacovigilance et de pharmacodynamie (ANSM, 28 juillet 2014)
Lettre du laboratoire Biocodex aux professionnels de santé (sur le site de l'ANSM, 28 juillet 2014)
Pharmacovigilance - Compte rendu de la réunion du 26 juin 2012 (ANSM, 31 octobre 2012)
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 2 minutes
2 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)
.jpg)

.jpg)
.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.