La réalisation d'essais cliniques hospitaliers est cruciale pour le développement de nouveaux médicaments (illustration).
Une augmentation du nombre d'essais cliniques, mais moins de patients inclus
Le crû « 2014 » de l'enquête du LEEM (analyse du 1er janvier 2012 au 31 décembre 2013) montre une augmentation du nombre d'essais sur le territoire (569 vs 559 en 2012), avec une diminution parallèle du nombre des centres d'investigation clinique (CIC) impliqués (2672 vs 3152 en 2012) et du nombre des patients inclus (14634 vs 22114 en 2012).
Cela s'explique, selon Soizic Courcier (présidente du groupe Attractivité de la France pour la recherche clinique, Leem), par la réduction des domaines pathologiques concernés : certaines aires thérapeutiques, en particulier les maladies cardiovasculaires et le diabète, apparaissent comme quasiment "abandonnées".
Par contre, l'onco-hématologie, l'infectiologie et les maladies rares sont le tiercé dominant des essais cliniques actuels :
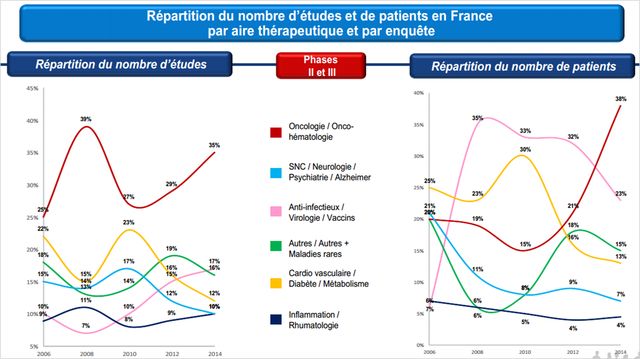
Le choix de privilégier ces 3 aires thérapeutiques s'explique par leur forte rentabilité ; elles valorisent aussi le partenariat public/privé en raison du haut degré d'expertise nécessaire, que la France hospitalo-universitaire possède. Par contre, ce ciblage réduit d'autant la dispersion des contrats et la population cible.
Des délais d'autorisation et de démarrage des essais de plus en plus longs
Le Leem souligne que la participation française aux essais cliniques internationaux est freinée par la lenteur des réponses administratives. Le délai médian d'une autorisation par l'ANSM est ainsi passé de 49 jours en 2012 à 55 en 2014. Quant au délai médian de réponse des Comités de protection des personnes (CPP), il est passé de 54 jours en 2012 à 62 jours en 2014, dépassant le délai administratif de 60 jours, soit une augmentation de 14,8 %.
La signature des contrats hospitaliers n'est pas plus aisée. Son délai médian augmente à 122,5 jours (111 jours en 2012), ce qui peut s'expliquer par des conditions disparates selon les établissements.
Un raccourcissement des délais attendu avec la mise en œuvre du "contrat unique hospitalier"
Le déploiement national du "contrat unique pour les recherches biomédicales à promotion industrielle dans les établissements de santé publics", qui fait partie des mesures instaurées par le Règlement UE n°536/2014 du Parlement et du Conseil européens du 16 avril 2014, devrait permettre de réduire ce délai.
Ce contrat est "unique" car il associe le promoteur industriel, l'établissement de santé et l'investigateur pour un même lieu de recherche (centre d'inclusion), mais également parce qu'il a vocation à être utilisé à l'identique par tous les établissements de santé souhaitant participer à l'essai clinique (français et/ou européens, via un portail internet unique).
Le contrat unique, qui vise donc à réduire les délais avant le démarrage des essais, est opérationnel en France depuis juin 2014 (Instruction N ° DGOS/PF4/2014/195). Les agences nationales de la recherche en attendent beaucoup, à commencer par des retombées pour les investigateurs dans les publications internationales, enjeu crucial de la compétition entre chercheurs.
"Simplifier et fluidifier le système"
Selon Patrick Errard, Président du Leem, "l'amélioration des délais et des performances françaises ne se décrète pas. Il faut fluidifier le système, le simplifier grâce à une meilleure synergie entre acteurs de la recherche clinique : industriels bien sûr mais aussi, médecins investigateurs, hôpitaux, patients, chercheurs, autorités administratives, CPP…C'est ce que nous tentons de faire, par la mise en place du contrat unique, mesure que nous avons fait avancer via le Comité stratégique de filière".
Cette "fluidification du système" pourrait permettre à la France d'endiguer l'allongement des délais, de renforcer la motivation des chercheurs et de maintenir sa compétitivité européenne et internationale (10 % des études internationales enregistrées sur clinicaltrials.gov sont réalisées en France).
Cette simplification mise en place pour les essais cliniques pourrait également s'appliquer à d'autres pans du système de santé français, à commencer par le travail quotidien des médecins libéraux freiné, voire embolisé par de multiples et croissantes contraintes administratives…
Pour aller plus loin :
Place de la France dans la recherche clinique internationale - Rapport 2014, Leem, mars 2015
Le Leem appelle tous les acteurs de la recherche à consolider la position française pour assurer l'innovation de demain, communiqué du Leem, 3 mars 2015
Le Règlement européen du contrat unique de recherche clinique, avril 2014
L'instruction DGOS d'application du règlement européen, juin 2014
La présentation des essais cliniques par l'ANSM
Les centres d'investigation clinique par l'INSERM
Les comités de protection des personnes (CPP)
Le contrat unique européen présenté par l'Académie de Pharmacie, novembre 2014
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire







Commentaires
Cliquez ici pour revenir à l'accueil.