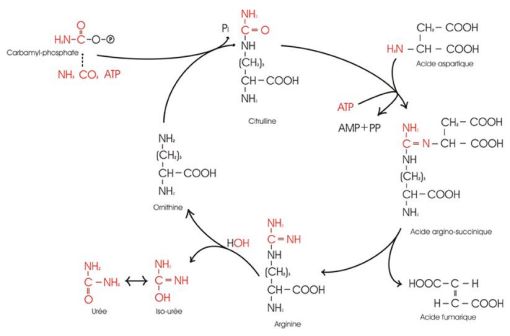
Cycle de l'urée (Illustration @Jmb462 sur fr.wikipedia).
RAVICTI 1,1 g/mL liquide oral (glycérol phénylbutyrate) est indiqué comme traitement adjuvant, pour la prise en charge au long cours de patients atteints de troubles du cycle de l'urée (urea cycle disorders, UCD), impliquant des déficits en carbamyl-phosphate synthétase I (CPS), ornithine carbamoyltransférase (OTC), argininosuccinate synthétase (ASS), argininosuccinate lyase (ASL), arginase I (ARG) et un déficit en ornithine translocase, syndrome de l'hyperornithinémie-hyperammoniémie-homocitrullinurie (HHH) qui ne peuvent pas être pris en charge uniquement par un régime alimentaire hypoprotéique et/ou par une supplémentation en acides aminés.
RAVICTI doit être associé à un régime alimentaire pauvre en protéines et, dans certains cas, à des suppléments alimentaires (par exemple, acides aminés essentiels, arginine, citrulline, suppléments caloriques sans protéines).
 RAVICTI fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
RAVICTI fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.Prévenir les crises hyperamoniémiques
L'objectif principal de la prise en charge des désordres du cycle de l'urée (DCU) est de prévenir la survenue de crises hyperammoniémiques par le contrôle des concentrations plasmatiques en ammoniaque.
Les DCU sont des déficits congénitaux en enzymes ou transporteurs nécessaires à la synthèse de l'urée à partir de l'ammoniaque (NH3, NH4+). L'absence de ces enzymes ou transporteurs conduit à l'accumulation de taux toxiques d'ammoniaque dans le sang ou dans le cerveau chez les patients affectés.
Le principe actif de RAVICTI est le phénylbutyrate de glycérol, une pro-drogue de l'acide 4-phénylbutyrique (PBA). Celui-ci est hydrolysé par des lipases pancréatiques pour donner du PBA, lequel est transformé par bêta-oxydation en PAA, le fragment actif du phénylbutyrate de glycérol. Le PAA se conjugue à la glutamine (qui contient 2 molécules d'azote) par acétylation dans le foie et les reins, pour former la PAGN (phénylacétylglutamine) qui est excrétée par les reins.
Sur une base moléculaire, la PAGN, comme l'urée, contient 2 moles d'azote et fournit une voie alternative pour l'excrétion des déchets azotés.
Le principe actif de RAVICTI est le phénylbutyrate de glycérol, une pro-drogue de l'acide 4-phénylbutyrique (PBA). Celui-ci est hydrolysé par des lipases pancréatiques pour donner du PBA, lequel est transformé par bêta-oxydation en PAA, le fragment actif du phénylbutyrate de glycérol. Le PAA se conjugue à la glutamine (qui contient 2 molécules d'azote) par acétylation dans le foie et les reins, pour former la PAGN (phénylacétylglutamine) qui est excrétée par les reins.
Sur une base moléculaire, la PAGN, comme l'urée, contient 2 moles d'azote et fournit une voie alternative pour l'excrétion des déchets azotés.
RAVICTI non inférieur à AMMONAPS sur le contrôle de la concentration plasmatique en ammoniaque
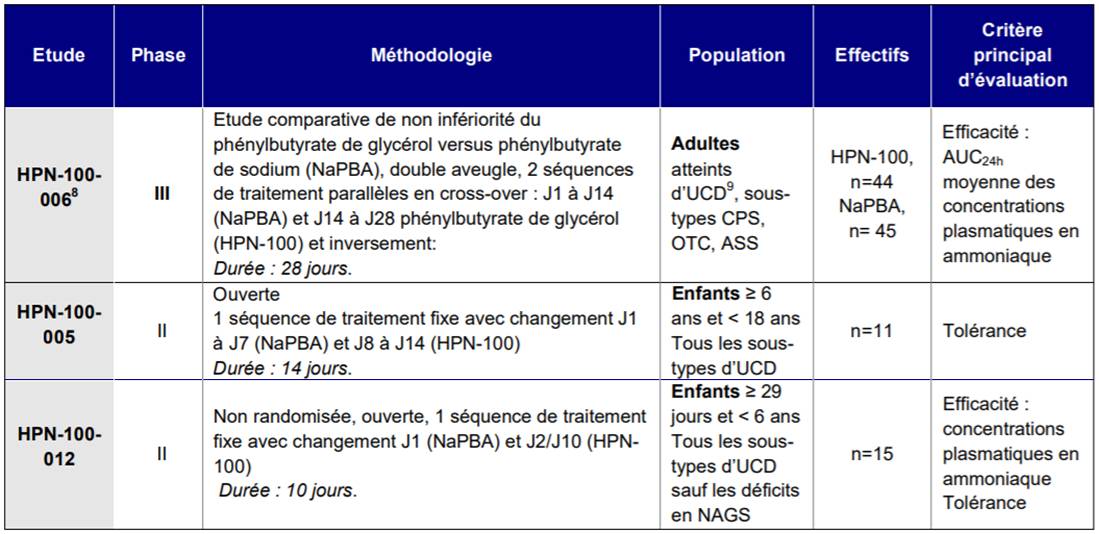
Dans son avis du 16 mai 2019, la Commission de la Transparence a évalué RAVICTI principalement sur la base de 3 études cliniques de phase II et III d'évaluation de l'efficacité et de la tolérance du phénylbutyrate de glycérol ou "HPN-100" par rapport au phénylbutyrate de sodium ou NaPBA (AMMONAPS) chez des adultes et en pédiatrie (Cf. Tableau I).
Tableau I - Etudes de phase II et III conduites avec RAVICTI
(extrait de l'avis de la Commission de la Transparence du 16 mai 2018)
(extrait de l'avis de la Commission de la Transparence du 16 mai 2018)
8. Diaz GA, Krivitzky LS, Mokhtarani M, et al. Ammonia control and neurocognitive outcome among urea cycle disorder patients treated with glycerol phenylbutyrate. Hepatology 2013;57: 2171–9.
9. UCD ou "Urea cycle disorders" : désordre du cycle de l'urée.
L'étude de phase III HPN-100-006 a démontré la non-infériorité de RAVICTI par rapport au NaPBA sur le contrôle de la concentration plasmatique en ammoniaque chez l'adulte atteint d'UCD (sous-types CPS, OTC, ASS).
L'étude de tolérance HPN-100-005 et l'étude HPN-100-012 ont mis en évidence, à titre exploratoire, la non infériorité de RAVICTI versus NaBPA sur le contrôle des concentrations plasmatiques en ammoniaque en comparaison au NaPBA chez les enfants de 6 ans à moins de 18 ans (tous les sous-type d'UCD) et chez ceux de 29 jours à moins de 6 ans respectivement (tous les sous-types d'UCD sauf les déficits en NAGS [N-acétylglutamate synthase]).
Une analyse groupée des résultats de ces 3 études et d'une étude de phase II d'escalade de dose versus NaPBA chez des patients adultes (étude UP 1204-003) a par ailleurs suggéré une différence en faveur de RAVICTI en comparaison au NaPBA sur les AUC0-24h moyennes des concentrations plasmatiques en ammoniaque, avec cependant des limites méthodologiques atténuant la portée des résultats de cette analyse post-hoc.
En termes de tolérance, dans l'étude chez l'adulte, le nombre de patients ayant eu au moins un événement indésirable (EI) a été de 51,1 % dans le groupe NaPBA et de 61,4 % dans le groupe RAVICTI, avec une sous-représentation des EI associés au NaPBA dans cette étude.
Les EI les plus fréquents ont été :
- des troubles gastro-intestinaux, à type de diarrhées, flatulences, douleurs abdominales, vomissements, dyspepsie, inconfort abdominal, nausées, inconfort oral) avec respectivement : 28,9 % versus 36,4 %,
- des troubles du système nerveux (étourdissements, maux de tête) avec respectivement : 15,6 % versus 15,9 %.
Concernant l'enfant entre 6 et 18 ans, 2 patients (18 %) ont rapporté au moins un EI sous traitement par NaPBA (lymphadénopathie et souffle cardiaque et baisse d'appétit liée au traitement) et 4 patients (36,4 %) ont rapporté au moins un EI sous traitement par RAVICTI dont vomissements (n = 1), douleurs abdominales hautes (n = 2), infection du système respiratoire supérieur et infection auriculaire (n = 1) et dermatite de contact (n = 1).
S'agissant de l'enfant âgé de 29 jours et jusqu'à 6 ans, la majorité des patients (9 sur 11) a eu une amélioration de leurs symptômes au 10e jour (après traitement par RAVICTI), en particulier concernant l'odeur corporelle (n = 5) et les vomissements récurrents (n = 5), 3 patients ont rapporté une amélioration concernant la survenue de vomissements, de douleurs abdominales et le refus de s'alimenter.
Après 1 an de traitement, la majorité des critères neuropsychologiques, notamment ceux portant sur les fonctions cognitives (test WASI ou Wechsler Adult Intelligence Scale) et le comportement (test CBCL ou Child Behavior Checklist), sont restés stables chez l'adulte et l'enfant.
Une amélioration des fonctions exécutives (test BRIEF ou Behavior Rating Inventory of Executive Function) a été observée chez les enfants d'âge >= 6 ans et < 18 ans.
Prenant en compte l'ensemble des données disponibles, la Commission de la Transparence considère que RAVICTI apporte un service médical rendu (SMR) important, sans amélioration du SMR (ASMR V) par rapport à AMMONAPS dans l'indication de l'autorisation de mise sur le marché (AMM).
RAVICTI en pratique
RAVICTI doit être prescrit par un médecin ayant l'expérience du traitement des troubles du cycle de l'urée.
Ce traitement doit être associé à un régime alimentaire pauvre en protéines et, dans certains cas, à des suppléments alimentaires (acides aminés essentiels, arginine, citrulline, suppléments caloriques sans protéines) en tenant compte de l'apport quotidien en protéines alimentaires nécessaires à la croissance et au développement.
Le traitement par RAVICTI sera poursuivi à vie sauf, en cas de greffe hépatique orthotopique.
- Schéma posologique et dose
La dose doit être arrondie au 0,1 mL supérieur le plus proche pour les patients âgés de moins de 2 ans et au 0,5 mL pour les patients âgés de 2 ans et plus.
Pour les calculs de posologie, il faut distinguer les patients qui n'ont jamais pris d'acide phénylbutyrique (initiation de traitement) et les patients qui passent du phénylbutyrate de sodium ou du phénylacétate de sodium/sodium benzoate en injection à RAVICTI.
Le schéma d'administration se calque sur les repas ou collations prises au cours de la journée : la dose totale quotidienne est donc divisée en plusieurs prises équivalentes administrées lors de chaque prise alimentaire de la journée.
- Mode d'administration : voie orale ou gastro-entérale
RAVICTI doit être pris avec les repas.
Une seringue pour administration orale est fournie dans les kits de démarrage, pour l'administration du liquide directement dans la bouche. La même seringue pour administration orale doit être utilisée pour toutes les doses de la même journée. Après la dernière dose de la journée, la seringue pour administration orale doit être jetée.
Le liquide ne doit pas être ajouté ni mélangé au grand volume d'un autre liquide.
En revanche, RAVICTI peut être ajouté à une petite quantité de compote de pommes, de ketchup ou de purée de courges ou mélangé à des préparations diététiques (Cyclinex-1, Cyclinex-2, UCD-1, UCD-2, Polycose, Pro Phree et Citrulline) ; il doit être administré dans les 2 heures s'il est conservé à 25° C, ou dans les 24 heures s'il est réfrigéré.
En cas d'administration par voie gastro-entérale, le liquide peut être apporté via une sonde de gastrostomie ou une sonde nasogastrique.
- Le kit de démarrage : 3 formats de seringue
Trois formats de seringue sont disponibles (correspondant à 3 présentations différentes) :
- seringue de 1 mL,
- seringue de 3 mL,
- seringue de 5 mL.
Ces tailles de seringue conviennent pour toutes les doses initiales possibles et leur nombre est suffisant pour une semaine de traitement.
Pour les dispensions suivantes, un conditionnement standard sans seringue est fourni.
Des seringues pour administration orale supplémentaires peuvent être obtenues à la pharmacie.
- Flacon ouvert : durée d'utilisation de 14 jours
Identité administrative
- Liste I
- Prescription hospitalière
- Flacon de 25 mL + 1 bouchon adaptateur, CIP 3400930095669
- Flacon de 25 mL + 7 seringues pour administration orale de 5 mL, CIP 3400930095690
- Flacon de 25 mL + 7 seringues pour administration orale de 3 mL, CIP 3400930095683
- Flacon de 25 mL + 7 seringues pour administration orale de 1 mL, CIP 3400930095676
- Agrément aux collectivités (Journal officiel du 11 juillet 2018 - texte 27)
- Inscription sur la liste de rétrocession (Journal officiel du 30 avril 2019 - texte 9)
- Laboratoire Swedish Orphan Biovitrum
Pour aller plus loin
Synthèse d'avis de la Commission de la Transparence - RAVICTI (mai 2018)
Avis de la Commission de la Transparence - RAVICTI (HAS, 18 avril 2018)
Diaz GA, Krivitzky LS, Mokhtarani M, et al. Ammonia control and neurocognitive outcome among urea cycle disorder patients treated with glycerol phenylbutyrate. Hepatology 2013;57: 2171–9
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire
.jpg)

.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.