![En France, le nombre de nouveaux cas de cancers de l’ovaire était de 5 193 patientes en 2018, faisant de ce cancer le 2e cancer gynécologique (source : INCa, 2018) [illustration].](https://vidalactus.vidal.fr/files/uploads/actus/images/ZEJULA-niraparib-cancer-ovaire-Fallope-peritoine-extension-prise-en-charge-traitement-entretien-premiere-ligne-monotherapie_resultat.jpg)
En France, le nombre de nouveaux cas de cancers de l’ovaire était de 5 193 patientes en 2018, faisant de ce cancer le 2e cancer gynécologique (source : INCa, 2018) [illustration].
Résumé :
Le périmètre de prise en charge (remboursement au taux de 100 % et agrément aux collectivités) de l'antinéoplasique ZEJULA 100 mg gélule (niraparib) est étendu au traitement d'entretien, en monothérapie, des patientes adultes atteintes d'un cancer épithélial avancé (stades FIGO III et IV) de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif, qui sont en réponse (réponse complète ou partielle) à une première ligne de chimiothérapie à base de platine.
Avec cette extension d'indication, ZEJULA est remboursable dans l'ensemble de ses indications thérapeutiques prévues par l'autorisation de mise sur le marché (AMM).
Le périmètre de prise en charge (remboursement au taux de 100 % et agrément aux collectivités) de l'antinéoplasique ZEJULA 100 mg gélule (niraparib) est étendu au traitement d'entretien, en monothérapie, des patientes adultes atteintes d'un cancer épithélial avancé (stades FIGO III et IV) de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif, qui sont en réponse (réponse complète ou partielle) à une première ligne de chimiothérapie à base de platine.
Avec cette extension d'indication, ZEJULA est remboursable dans l'ensemble de ses indications thérapeutiques prévues par l'autorisation de mise sur le marché (AMM).
La prise en charge de l'inhibiteur des PARP [enzymes poly(ADP-ribose) polymérase] à base de niraparib, ZEJULA 100 mg gélule, est étendue en monothérapie dans le traitement d'entretien de patientes adultes atteintes d'un cancer épithélial avancé (stades FIGO III et IV) de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif qui sont en réponse (réponse complète ou partielle) à une première ligne de chimiothérapie à base de platine.
Cette extension de prise en charge concerne le remboursement en ville (100 %) et l'agrément aux collectivités, et s'applique aux deux présentations de ZEJULA (boîtes de 56 et de 84).
Avec cette extension de prise en charge, ZEJULA est remboursable dans toutes ses indications thérapeutiques prévues par l'AMM (cf. Encadré 1).
Encadré 1 - Indications thérapeutiques de ZEJULA
|
Avant d'obtenir cette extension de prise en charge, ZEJULA a bénéficié d'une prise en charge dans une indication comparable mais plus restreinte (cf. Encadré 2), en relais de l'autorisation temporaire d'utilisation de cohorte (ATUc) accordée à ZEJULA de juillet 2020 à mars 2021.
En comparaison à l'indication de l'ATUc, les critères de "non mutation du gène BRCA" et "de non éligibilité au bévacizumab" ont disparu dans l'indication de l'AMM (correspondant à l'indication prise en charge).
Encadré 2 - Indication de l'ATUc accordée à ZEJULA en 2020
| Traitement d'entretien de patientes adultes atteintes d'un cancer avancé de haut grade de l'ovaire (stades FIGO III et IV), des trompes de Fallope ou péritonéal primitif, sans mutation du gène BRCA, qui sont en réponse (réponse complète ou partielle) à une première ligne de chimiothérapie à base de platine et non éligibles au bévacizumab. |
Recommandations posologiques dans le traitement d'entretien du cancer de l'ovaire en première ligne
Dans cette indication nouvellement prise en charge, la dose initiale recommandée de niraparib est de 200 mg en 1 prise par jour, soit 2 gélules de ZEJULA 100 mg.
Toutefois, pour les patientes dont le poids est > 77 kg et dont la numération plaquettaire de base est > 150 000/µL, la dose initiale recommandée de niraparib est de 300 mg (3 gélules de ZEJULA 100 mg), en 1 prise par jour.
SMR important et ASMR mineure
Pour cette indication, la Commission de la Transparence (CT) a attribué à ZEJULA (avis du 3 mars 2021) :
- un service médical rendu (SMR) important,
- une amélioration du SMR mineure (ASMR IV).
La CT a pris en compte les résultats de l'étude pivot de phase III PRIMA (1, 2), comparative versus placebo, randomisée, stratifiée, en double aveugle et en groupes parallèles, dont l'objectif était de démontrer la supériorité du traitement d'entretien par niraparib par rapport au placebo en termes de survie sans progression (SSP - critère de jugement principal) chez des patientes atteintes d'un cancer de l'ovaire de stade III ou IV (y compris les cancers de Fallope et péritonéal) avec une réponse complète ou partielle au traitement par chimiothérapie à base de platine en première ligne.
La SSP était évaluée par une revue centralisée par un Comité de revue indépendant (BICR ; Blinded Independent Central Review) et définie comme le délai entre la date de randomisation et la date de survenue d'une progression de la maladie ou la date de décès quelle qu'en soit la cause. L'analyse principale était effectuée en ITT.
Les résultats de cette étude (cf. Figure 1) montrent un gain en médiane de SSP de +5,6 mois en valeur absolue par rapport au placebo en ITT, soit 13,8 mois dans le groupe niraparib versus 8,2 mois dans le groupe placebo (HR = 0,62 ; IC95 % : [0,502 ; 0,755]).
Figure 1 - Étude PRIMA – Courbes de Kaplan-Meier de survie sans progression (population ITT)
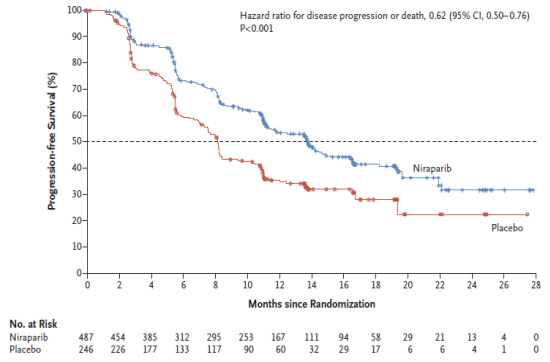

En termes de tolérance, les arrêts de traitement pour événements indésirables (EI) sont survenus chez 12% des patients du groupe niraparib et 2,5 % des patients du groupe placebo.
L'incidence des EI de grades > 3 a été de 70,5 % dans le groupe niraparib et de 18,9 % dans le groupe placebo. La principale toxicité a été une myélosuppression (anémie, thrombopénie).
En conclusion de son avis, la CT considère que la place de ZEJULA dans la stratégie thérapeutique est celle d'une "option de traitement d'entretien de première ligne du cancer épithélial avancé (stades FIGO III et IV) de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif et qui sont en réponse partielle ou complète a? une première ligne de chimiothérapie à base de platine".
Pour aller plus loin
Arrêté du 3 novembre 2021 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux (Journal officiel du 9 novembre 2021 - texte 26)
Arrêté du 3 novembre 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics (Journal officiel du 9 novembre 2021 - texte 27)
Avis de la Commission de la Transparence - ZEJULA (HAS, 3 mars 2021)
Les études pivot :
(1) González-Martín A, et al. Niraparib in Patients With Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med 2019 ; 381(25) : 2391-2402.
(2) Supplement to: González-Martín A, Pothuri B, Vergote I, et al. Niraparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2019 ; 381(25) : 2391-2402
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire.jpg)

.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.