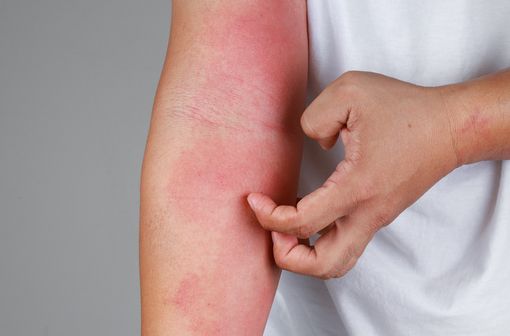
Lésions de dermatite atopique.
L'inhibiteur des Janus kinases RINVOQ 15 mg comprimé à libération prolongée (upadacitinib) bénéficie d'une extension de prise en charge (remboursement à 65 % et agrément aux collectivités) dans le traitement de la dermatite atopique de l'adulte et de l'enfant de 12 ans et plus.
En complément, un nouveau dosage de RINVOQ à 30 mg d'upadacitinib est mis à disposition, avec un remboursement limité à la dermatite atopique de l'adulte.
Cette prise en charge, de périmètre différent selon le dosage de RINVOQ, est cohérente avec les recommandations posologiques.
Dans le traitement de la dermatite atopique en effet, la dose recommandée d'upadacitinib est de :
- 15 ou 30 mg 1 fois par jour chez l'adulte ;
- 15 mg chez l'adolescent à partir de 12 ans jusqu'à 17 ans.
Le remboursement est conditionné au respect des conditions de prescription suivantes :
- prescription initiale hospitalière, et prescription initiale et renouvellement restreints à certains spécialistes ;
- médicament d'exception nécessitant une ordonnance spécifique.
Au sein de la gamme RINVOQ (upadacitinib), RINVOQ 15 mg comprimé à libération prolongée (LP) bénéficie d'une extension de prise en charge dans le traitement de la dermatite atopique de l'adolescent et de l'adulte. En parallèle, un nouveau dosage de RINVOQ à 30 mg d'upadacitinib est commercialisé, avec un remboursement dans la dermatite atopique de l'adulte uniquement.
RINVOQ 15 mg LP : prise en charge étendue en dermatologie, chez l'adulte et l'adolescent
Commercialisé depuis 2020 en France (cf. notre article du 8 juillet 2020), RINVOQ 15 mg comprimé à libération prolongée (LP) bénéficie d'une extension de remboursement (65 %) et d'agrément aux collectivités dans le traitement de la dermatite atopique modérée à sévère [1, 2] :
- de l'adulte qui nécessite un traitement systémique, après échec, contre-indication ou intolérance à la ciclosporine (cf. VIDAL Reco « Dermatite atopique de l'adulte ») ;
- de l'adolescent âgé de 12 ans et plus qui nécessite un traitement systémique (cf. VIDAL Reco « Dermatite atopique de l'enfant »).
L'autorisation de mise sur le marché (AMM) dans la dermatite atopique a été attribuée à RINVOQ 15 mg en août 2021 (cf. Encadré 1). Auparavant, RINVOQ a bénéficié d'une autorisation temporaire d'utilisation (ATU) dans le traitement de la dermatite atopique modérée à sévère de l'adulte qui nécessite un traitement systémique, en cas de contre-indication, d'intolérance ou d'échec aux traitements disponibles. Après l'obtention de son AMM, une autorisation d'accès précoce (AAP) a été accordée à RINVOQ dans cette indication de dermatologie.
|
Un nouveau dosage à 30 mg pour satisfaire la posologie chez l'adulte
En complément de l'extension d'indication de RINVOQ 15 mg dans la dermatite atopique chez l'adolescent et l'adulte, le laboratoire Abbvie commercialise un nouveau dosage de RINVOQ à 30 mg d'upadacitinib, afin de répondre aux recommandations posologiques chez l'adulte dans cette indication.
RINVOQ 30 mg comprimé LP dispose donc des mêmes indications que le dosage à 15 mg (cf. Encadré 1). Toutefois, dans le traitement de la dermatite atopique, la prise en charge de RINVOQ 30 mg LP est accordée uniquement chez l'adulte :
- traitement de la dermatite atopique modérée à sévère de l'adulte qui nécessite un traitement systémique, après échec, contre-indication ou intolérance à la ciclosporine.
En effet, chez l'adolescent, la dose d'upadacitinib recommandée est de 15 mg ; le remboursement de RINVOQ 30 mg LP dans cette population ne serait pas cohérent avec la posologie de l'AMM.
Un périmètre de prise en charge restreint par rapport à l'indication de l'AMM
Un avis commun, mais des conclusions différentes en fonction de l'âge
La Commission de la transparence (CT) a émis un avis commun à RINVOQ 15 mg LP (extension de prise en charge) et RINVOQ 30 mg LP (nouveau dosage) [3].
Dans le traitement de la dermatite atopique modérée à sévère de l'adulte, elle a attribué à RINVOQ 15 mg et 30 mg :
- un service médical rendu (SMR) important uniquement en cas d'échec, d'intolérance ou de contre-indication à la ciclosporine ;
- un SMR insuffisant chez les patients naïfs de ciclosporine.
La CT estime que RINVOQ apporte une amélioration du service médical rendu (ASMR) mineure par rapport au dupilumab (DUPIXENT) chez l'adulte, dans ce périmètre d'indication restreint.
Dans le traitement de la dermatite atopique de l'adolescent (12 ans et plus), elle a attribué un SMR important dans l'indication de l'AMM, mais estime que RINVOQ n'apporte pas d'ASMR.
Comparaison au placebo et au dupilumab
L'évaluation de l'upadacitinib par la CT a notamment reposé sur les études suivantes :
- Measure-Up 1 et 2, deux études de supériorité, de même méthodologie, randomisées, en double aveugle, multicentriques, ayant comparé l'upadacitinib 15 et mg 30 mg au placebo chez l'adulte et l'adolescent : la supériorité de l'upadacitinib en monothérapie a été démontrée par rapport au placebo, avec une quantité d'effet importante, en termes de réponses IGA 0 ou 1, EASI-75, EASI 90, EASI-100 (cf. Encadré 2) et de prurit après 16 semaines de traitement ;
- AD-Up, une étude de supériorité, randomisée, en double aveugle, multicentrique, ayant comparé l'upadacitinib 15 mg et 30 mg en association à un dermocorticoïde (DC) versus un DC seul, chez l'adulte et l'adolescent : la supériorité de l'upadacitinib 15 mg et 30 mg en association à un DC a été démontrée par rapport à un DC seul en termes de réponses EASI-75 et d'IGA 0 ou 1 à 16 semaines ;
- Heads-Up, une étude de supériorité, randomisée, en double aveugle, multicentrique, ayant comparé l’upadacitinib 30 mg au dupilumab 300 mg (DUPIXENT) chez l’adulte chez l'adulte : la supériorité de l'upadacitinib 30 mg a été démontrée par rapport au dupilumab en termes de réponse EASI-75 (71 % versus 61,1 % , p = 0,006), de réponse EASI-90 (60,6 % versus 38,8 %, p < 0,001) et de variation du score de prurit (WP-NRS : -66,88 versus -49,04, p < 0,001) [cf. Encadré 2] après 16 semaines de traitement.
|
RINVOQ en pratique dans la dermatite atopique
Chez l'adulte, la dose recommandée d'upadacitinib est de 15 mg ou 30 mg 1 fois par jour, selon les caractéristiques individuelles de chaque patient.
Une dose de 30 mg 1 fois par jour peut être appropriée :
- chez les patients ayant un fort retentissement de la maladie ;
- chez les patients ayant présenté une réponse inadéquate à la dose de 15 mg 1 fois par jour.
En traitement d'entretien, la dose efficace la plus faible doit être envisagée.
Pour les patients âgés de 65 ans et plus, la dose recommandée est de 15 mg 1 fois par jour.
Chez l'adolescent (de 12 à 17 ans), la dose recommandée d'upadacitinib est de 15 mg 1 fois par jour chez les adolescents pesant au moins 30 kg.
Identité administrative de RINVOQ 30 mg LP
Liste I
Prescription initiale hospitalière annuelle
Prescription initiale et renouvellement réservés aux spécialistes en rhumatologie, en médecine interne, en dermatologie, en allergologie ou en hépato-gastro-entérologie
Boîte de 28, CIP 3400930234006
Remboursable à 65 % (cf. Encadré 3) sur ordonnance de médicament d'exception [1] : prescription en conformité avec la fiche d'information thérapeutique (FIT)
Prix public TTC = 1218,61 euros TTC [4]
Agrément aux collectivités (cf. Encadré 3) [2]
Laboratoire Abbvie
|
[1] Arrêté du 15 novembre 2022 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - FIT de RINVOQ (Journal officiel du 18 novembre 2022, texte 23)
[2] Arrêté du 15 novembre 2022 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - RINVOQ (Journal officiel du 18 novembre 2022, texte 24)
[3] Avis de la Commission de la transparence - RINVOQ (HAS, 15 décembre 2021)
[4] Avis relatif aux prix d'une spécialité pharmaceutique - RINVOQ LP 30 mg (Journal officiel du 18 novembre 2022)

 7 minutes
7 minutes Ajouter un commentaire
Ajouter un commentaire
.jpg)

.jpg)




Commentaires
Cliquez ici pour revenir à l'accueil.